1. Isolierung und Fragmentierung der Spender-DNA
- Die Zellmembran sowie die Kernhülle der eukaryotischen Spender-Zelle werden zerstört und ihre Proteine werden enzymatisch abgebaut. Die DNA wird mit Ethanol ausgefällt.
- Die DNA wird mit einem bestimmten Restriktionsenzym in kleinere, mehrere tausend Basenpaare lange DNA-Fragmente aufgeschnitten.
- Diese DNA-Fragmente besitzen je nach verwendetem Restriktionsenzym Sticky Ends ("klebrige Enden") mit einer bestimmten Basensequenz.

|
|
- Damit die überflüssigen Introns nicht mit übertragen werden, wird zunächst aus der reifen mRNA mit Hilfe des Enzyms Reverse Transkriptase die sogenannte "complementary"-DNA (cDNA) hergestellt, die dann nur noch die Exon-Abschnitte des gewünschten Gens enthält. Diese cDNA wird dann nach Anfügen der Sticky Ends in Schritt 3 eingebaut.
- Die cDNA wird meist vor dem Anfügen der Sticky Ends noch mittels der Polymerase-Kettenreaktion (Polymerase-Chain-Reaction, PCR) vervielfältigt.
2. Isolierung und Aufschneiden eines geeigneten Vektor-Plasmids
- Plasmide sind kleine ringförmige DNA-Moleküle in Bakterien mit einer begrenzten Anzahl von Genen. Bakterien können Plasmide untereinander durch Konjugation austauschen und so zusätzliche Fähigkeiten wie z.B. Antibiotika-Resistenzen oder zusätzliche Stoffwechselwege weitergeben.
- Ein künstliches
Vektor-Plasmid hat meist den folgenden Aufbau:
- Ampillicin-Resistenz-Gen (AmpR) mit einer Schnittstelle für ein bestimmtes Restriktionsenzym, da im Rahmen der Hybridisierung (s.u.) genau an dieser Schnittstelle die Fremd-DNA eingefügt wird.
- Tetracyclin-Resistenz-Gen (TetR)
- Das Aufschneiden des Vektor-Plasmids erfolgt mit dem gleichen Restriktionsenzym wie das Aufschneiden der Spender-DNA. Die Spender-DNA-Fragmente besitzen also die gleichen Sticky Ends ("klebrigen Enden").
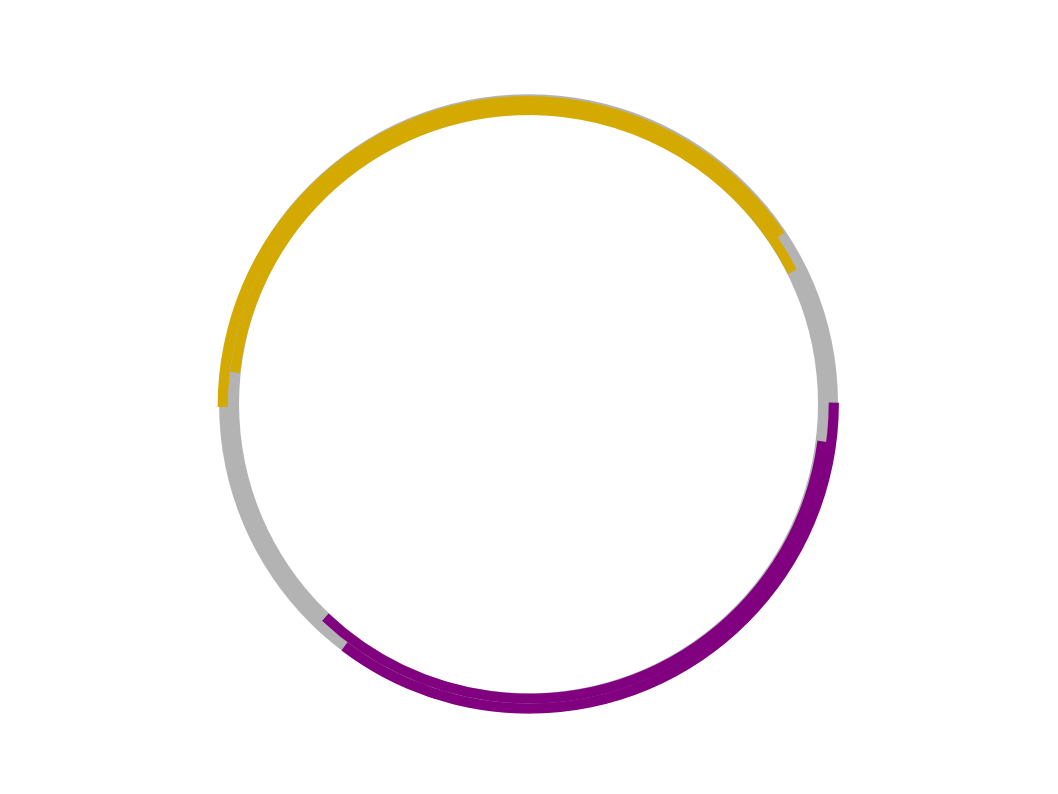
|
|
- Wenn das Ziel die Gewinnung des Proteins als Genprodukt des Fremdgens ist, wird in das Vektor-Plasmid zusätzlich ein Regulationssystem in den Vektor eingebaut. Dieses besteht aus (1) Regulatorgen, (2) Operator und Promotor sowie (3) einem Strukturgen. Das eingebaute Fremdgen wird dann als zweites Strukturgen gemeinsam mit dem "normalen" Strukturgen mit exprimiert. Durch Zugabe oder Entzug des entsprechenden Substrats kann die Genexpression beider Genprodukte dann gesteuert werden.
- Im Vektor-Plasmid müssen zwei Markergene (also Antibiotika-Resistenzgene)
enthalten sein. Da das Plasmid aber mehrere Schnittstellen für
verschiedene Restriktionsenzyme enthält, kann alternativ
auch das andere
Antibiotika-Resistenzgen durch Einbau des Fremdgens inaktiviert werden.
Je nach verwendetem (Schul-)Buch als Quelle findet man also auch
Beispiele, bei denen umgekehrt zu dem hier in diesem Programm
beschriebenen Fall das Tetracyclin-Resistenz-Gen inaktiviert wird und
das Ampillicin-Resistenz-Gen intakt bleibt.
Tipp: Wie würde sich (1) die Versuchsreihenfolge und (2) die Versuchsbeobachtung in Schritt 5 ändern?
3. Hybridisierung
- In einer Suspension werden die offenkettigen DNA-Fragmente aus Schritt 1 mit den ebenfalls offenkettigen Vektor-Plasmiden aus Schritt 2 vermischt.
- Durch Verknüpfung der Sticky Ends können
mit Hilfe von zugegebenen
Ligasen
die folgenden drei
Kombinationsmöglichkeiten entstehen:
- gewünscht:
Das passende Spender-DNA-Fragment wird im Bereich des Ampillicin-Resistenz-Gens in das Vektor-Plasmid eingebaut. Es entsteht ein neu kombiniertes (rekombinantes) Vektor-Hybrid-Plasmid. - unerwünscht:
Das Vektor-Plasmid schließt sich wieder im Bereich des Ampillicin-Resistenz-Gens. - ebenfalls unerwünscht:
Das Spender-DNA-Fragement schließt sich zu einem ringförmigen Plasmid zusammen.
- gewünscht:
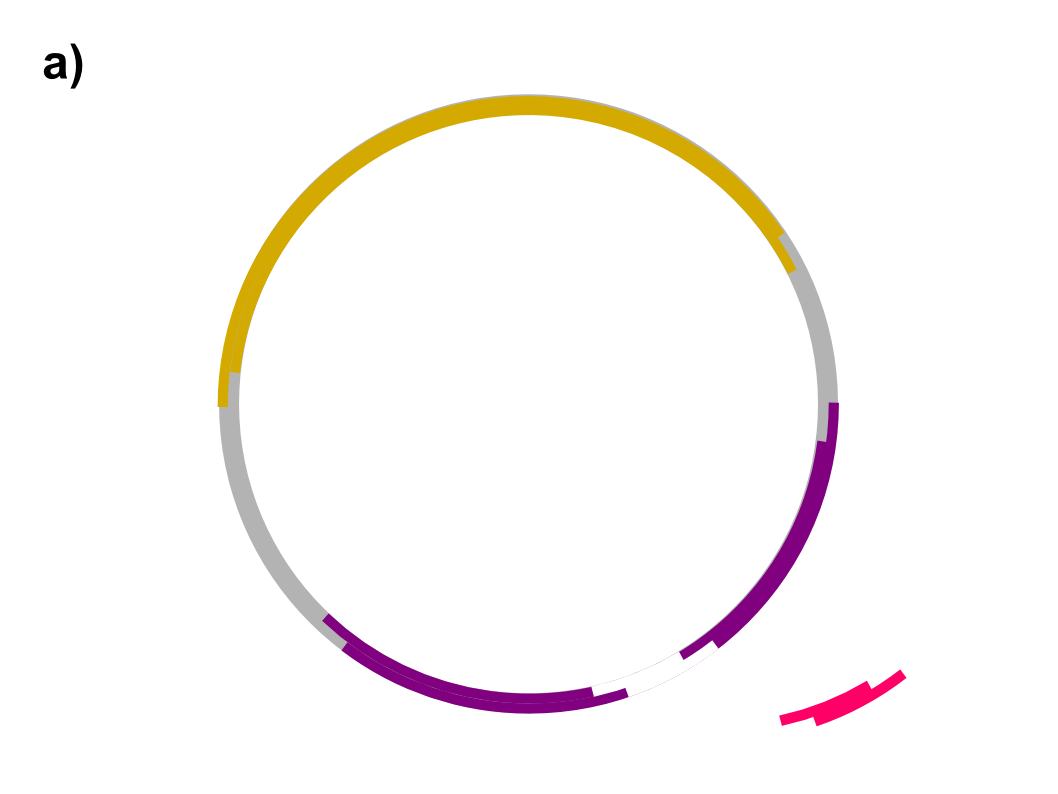
|
|
4. Transformation
- Die in Schritt 3...
- ...neu kombinierten (rekombinierten) Vektor-Hybrid-Plasmide a) sowie auch die
- ...nicht neu kombinierten "original"-Vektor-Plasmide b) und die
- ...entstandenen ringförmigen Spender-DNA-Plasmide c)
- Hierfür stehen verschiedene Methoden zur Durchlässigmachung
der Wirtszellmembran Verfügung:
- Chemische Behandlung der Zelle mit Calciumionen (Ca²⁺) (v.a. bei Bakterienwirtszellen)
- Elektrische Impulse (Elektroporation) (v.a. bei pflanzlichen Wirtszellen)
- Modifizierte Viren (meist Retroviren) (v.a. bei pflanzlichen Wirtszellen)
- Mikroinjektion (v.a. bei tierischen Wirtszellen)
- Im nächsten Schritt 5 muss sichergestellt werden, dass...
- ...später nur solche Zellen vermehrt werden, die ein neu kombiniertes (rekombiniertes) Vektor-Hybrid-Plasmid aufgenommen haben und dass
- ...das in diesem Plasmid enthaltene und somit mit diesem übertragene Gen auch funktionsfähig ist.
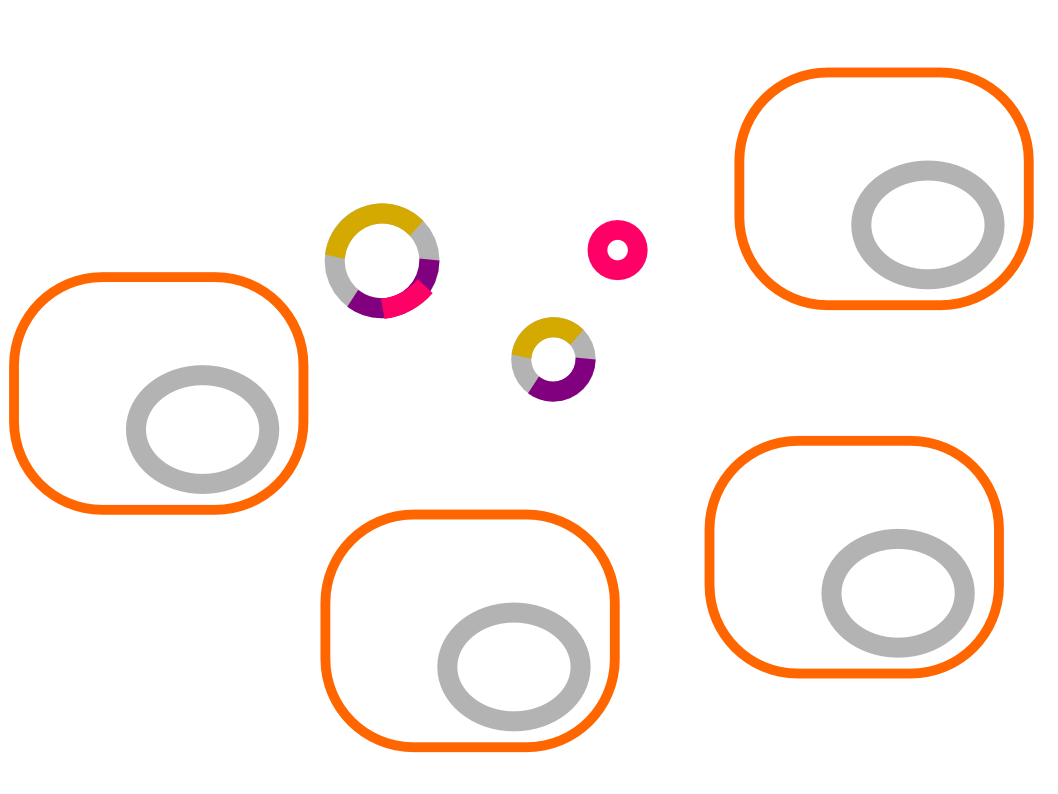
5. Selektive Identifizierung und Vermehrung (Klonierung)
| Nährboden enthält... |
a) Zellen mit rekombiniertem
Vektor-Hybrid-Plasmid |
b) Zellen mit nicht neu kombiniertem "original"-Vektor-Plasmid |
c) Zellen ohne Plasmid oder nur mit Spender-DNA-Plasmid |
| ...Tetracyclin | + | + | - |
| ...Ampillicin | - | + | - |
| ⇒ Ampillicin-Resistenzgen zerstört, da dort die Spender-DNA mit dem Fremd-Gen eingebaut wurde |
⇒ beide Resistenzgene | ⇒ kein Resistenzgen |
- Je nach Ziel wird mit den genetisch identischen Zellen (Klonen)
aus a) wie folgt weiterverfahren:
- Ziel DNA-Gewinnung ⇒ Vermehrung der Einzelzellen und anschließende Isolierung der DNA
- Ziel Protein-Gewinnung: ⇒ Vermehrung der Einzelzellen, Anregung der Genexpression und anschließende Isolierung des Proteins, z.B. Somatostatin, Somatotropin, Insulin, Erythropoetin (EPO), Plasminogenaktivator (TPA)
- Ziel Pflanze mit neuen Eigenschaften ⇒ Regeneration eines mehrzelligen Organismus

|
|
- Da in Schritt 1 viele unterschiedliche DNA-Fragmente entstehen, von denen prinzipiell jedes im Schritt 3 in das Vektor-Plasmid eingebaut werden könnte, muss in Schritt 5 nach dem Test auf die Antibiotika-Resistenzen, ob überhaupt ein rekombiniertes Vektor-Plasmid in die Zelle aufgenommen wurde, zusätzlich noch mit Hilfe einer Gensonde getestet werden, ob das richtige Spender-Gen in funktionsfähiger Form übetragen wurde. Eine Nachweismethode für das Vorhandensein der gewünschten DNA-Sequenz bietet der sogenannte Southern Blot.